シアル酸の科学
シアル酸 ―現代新薬の創製まで―
- 第3章 シアル酸とその誘導体の生理活性
- 1 シアル酸の生理活性
- 2 免疫を調節してガン転移をおさえるシアル酸誘導体
- 3 神経細胞を伸ばすシアル酸誘導体
- 4 インフルエンザの妙薬
- 文献・注
第3章 シアル酸とその誘導体の生理活性
1 シアル酸の生理活性
1−1 一般薬理作用1)
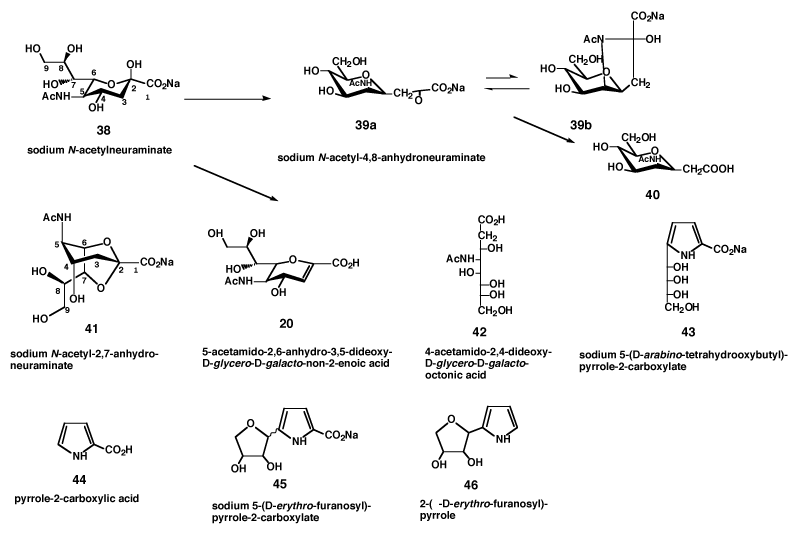
燕窩から希硫酸で加水分解してとり出したシアル酸はN-アセチルノイラミン酸(第1章参照)であるが、ナトリウム塩(38)とすると水溶性が更に向上するから,その結晶をX線解析して構造を明らかにして2)各種の薬理試験がなされた。
先ず,N-アセチルノイラミン酸ナトリウム(38)の熱や光に対する安定性が試験された。熱では粉体のまま140℃;3時間の加熱後,セルロースでクロマトグラフィーを行なって精製すると,原料(38)が42.0%回収されるほかに,化合物(39)が53.0%得られた。また,水溶液中で80℃に加温すると,アルカリ性では原料(38)が24.4%,化合物(39)が38.8%得られた。同様に酸性で加温すると,原料(38)が17.1%,化合物(39)が32.8%得られた。3)
この実験を精査すると,多くの副生品が出来ることが分かった。その結果は図-19と表-14にまとめてある。光による分解では,化合物(42)が5.2%得られた。4)
ここで問題になるのは,第2章で論じた燕窩のムチンのシアル酸が4,5-ジアセチルノイラミン酸ではなかろうかという疑問である。Pozsgayらの報告では,5)その根拠として4,5-位にアセチル基が存在すると、化合物(39)が得られることをあげているが,この熱安定性試験の結果は5-位にアセチル基が存在することだけで,この反応が進行することを示していることである。4-位のアセチル基は必ずしも必要でないことを示した。
| 分 解 条 件 | |||||
| 化合物番号 | アルカリ性 | 中性 | 酸性 | 固体 | 紫外線 |
| 39 | + | + | + | + | |
| 40 | + | + | |||
| 41 | + | + | |||
| 20 | + | + | + | + | |
| 42 | + | ||||
| 43 | + | + | + | + | |
| 44 | + | + | + | + | |
| 45 | + | + | + | + | |
| 46 | + | ||||
(構造式は図-19)
1−2 急性毒性6,7)
N-アセチルノイラミン酸ナトリウムのマウス,ラット,モルモットに対する経口,皮下注射,腹腔注射,静脈注射,吸入投与による急性毒性は、表-15に示すとおりである。マウスはICR系,ラットはSD系,モルモットはHartley系、それぞれ6週令を用い,薬物濃度は20%(w/v)の蒸留水溶液を用いた。1レベルの動物数はそれぞれ10匹とし,観察期間は14日,LD50の算出はProbit法によった。
| 動物種 | 性別 | 経口 | 皮下 | 腹腔 | 静脈 | 吸入 |
| マウス | ♂ | >5000 | >5000 | >5000 | 6286(5679-7084) | − |
| マウス | ♀ | >5000 | >5000 | >5000 | 7951(7214-9073) | − |
| ラット | ♂ | >5000 | >5000 | >5000 | 2966(2638-3342) | >4000mg/m3 |
| ラット | ♀ | >5000 | >5000 | >5000 | >5000 | >4000mg/m3 |
| モルモット | ♂ | − | − | − | 2856(2355-4087) | − |
吸入はミスト化し、1時間暴露:( )内は95%信頼限界
この結果は「急性毒性はない」と結論させるものである。
1−2−1 一般症状
N-アセチルノイラミン酸ナトリウムをマウスに100mgおよび500mg/kg i.p.投与では全く行動に異常が認められない。しかし、1000mg/kg i.p.投与では軽度の異常反応を示したが、3時間後には回復して死亡例はない。
1−2−2 中枢神経に対する作用
a)ペントバルビタールの睡眠作用に及ぼす影響
前投与群の睡眠時間の平均値は表-16にまとめてあるように、30mg/kg投与群では対照群(生理食塩水)よりわずかに増大し、100〜1000mg/kg投与群では逆に減少の傾向が見られるが、有意義な変化とは認められない。
| 薬 物 | 量(mg/kg) | 睡眠時間(min) | 比 |
| 生理食塩水 | − | 62.2 ±3.8 | 1 |
| 試 料 | 30 | 64.3 ± 2.5 | 1.03 |
| “ ” | 100 | 58.1 ± 3.9 | 0.93 |
| “ ” | 300 | 54.4 ± 2.0 | 0.87 |
| “ ” | 1000 | 58.5 ± 2.5 | 0.94 |
b)トレモリン誘発振戦作用に及ぼす影響
トレモリン15mg/kg i.p.でマウスは振戦、流涎、流涙、下痢の諸症状を呈するが、30、100、300および1000mg/kgのN-アセチルノイラミン酸ナトリウム前投与の結果はややばらつきのあるデータであるが、対照群との間に統計的に有意義な差は認められない。
c)ペンチレンテトラゾール誘発等痙攣に及ぼす影響
30、100、300および1000mg/kgのN-アセチルノイラミン酸ナトリウム前投与の結果はペンチレンテトラゾール誘発の痙攣発作にたいして、有意義な影響は認められない。同様にストリキニーネ誘発痙攣、および電撃痙攣に対しても同様に影響を与えない。
その他、マウスの自発運動量、体温、脳波などへの影響はない。
1−2−3 呼吸および循環器系に対する作用
a)麻酔イヌの呼吸および循環器系に及ぼす影響
ペントバルビタール麻酔下のイヌの呼吸運動は、N-アセチルノイラミン酸ナトリウムを3、10、30および100mg/kgずつ、1時間間隔で静脈内に累積投与し、呼吸、血圧、心拍数、心電図および血流量になんの変化も与えない。
b)麻酔ウサギの呼吸および循環器系に及ぼす影響
ウレタン麻酔のウサギの呼吸運動は,N-アセチルノイラミン酸ナトリウムを3、10、30および100mg/kgずつ,1時間間隔で静脈内に累積投与し,呼吸,血圧,心拍数になんの変化もない。
c)摘出右心房に及ぼす影響
モルモット摘出右心房の律動収縮曲線を描記しながら,N-アセチルノイラミン酸ナトリウムを10−6、10−5、10−4および10−3g/mLの濃度で投与し、心拍数と収縮力におよぼす影響を検討したがなんの変化もない。
1−2−4 自律神経系に対する作用
a)摘出回腸運動に及ぼす影響
マグヌス法によるモルモット摘出回腸運動は最終濃度10−6〜10−3g/mL のN-アセチルノイラミン酸ナトリウム投与で何の影響も与えなかった。また、アセチルコリンおよび、ヒスタミンで誘発される縦走筋収縮に対しても全く影響を与えない。
同様に,モルモットの摘出輸精管のアドレナリン収縮,ウサギの摘出血管に対するノルアドレナリンの効果,ウサギの摘出気管平滑筋,ウサギの瞳孔径に対しても有意義な変化を与えない。
| 試料(mg/kg) | 0 | 5 | 15 | 30 | 60 | 90(min) |
| 食塩水 | 0.54 ± 0.02 | 0.56 ± 0.03 | 0.57 ± 0.03 | 0.57 ± 0.05 | 0.57 ± 0.04 | 0.57 ± 0.04 |
| 試料 3 | 0.58 ± 0.02 | 0.59 ± 0.02 | 0.59 ± 0.01 | 0.59 ± 0.01 | 0.60 ± 0.02 | 0.60 ± 0.01 |
| 試料 10 | 0.59 ± 0.04 | 0.59 ± 0.04 | 0.57 ± 0.04 | 0.59 ± 0.04 | 0.58 ± 0.03 | 0.59 ± 0.04 |
| 試料 30 | 0.50 ± 0.01 | 0.50 ± 0.01 | 0.50 ± 0.01 | 0.49 ± 0.01 | 0.51 ± 0.02 | 0.52 ± 0.02 |
| 試料 100 | 0.58 ± 0.04 | 0.58 ± 0.05 | 0.62 ± 0.07 | 0.58 ± 0.04 | 0.58 ± 0.04 | 0.57 ± 0.03 |
1−2−5 前脛骨筋収縮運動に対する作用
ウレタン麻酔ウサギの前脛骨筋収縮運動をN-アセチルノイラミン酸ナトリウムの3、10、30および100mg/kgを静脈に60分毎に累積投与して変化を見ない。
1−2−6 局所麻酔作用
N-アセチルノイラミン酸ナトリウムの3、10および30%溶液をウサギに点眼して角膜刺激によるまばたき反射を検討し、5〜120分後の観察に何の効果も示さない。
1−2−7 腎機能試験
N-アセチルノイラミン酸ナトリウムの30、100、300および1000mg/kg i.p. 投与したウサギの5時間の尿試験を行ない,pH,尿蛋白,糖,潜血およびウロビリノーゲンに影響を与えない。
1−2−8 血液系に対する作用
a)血液凝固試験
N-アセチルノイラミン酸ナトリウムは対照群に対してやや血液凝固時間の延長傾向を示したが,有意義な作用とは認められない。
b)溶血試験
N-アセチルノイラミン酸ナトリウムは対照群に対して全く溶血作用を示さない。
c)血小板凝集に及ぼす影響
N-アセチルノイラミン酸ナトリウムは対照群に対して,5×10−3, 10−2および1.5×10−2g/mLの高濃度でコラーゲン凝集に対して抑制効果を示す。また、ADP凝集に対しても用量依存性の抑制効果を示す。
| 試料 | 用量(g/mL) | 観察数 | 血液凝集時間(秒) |
| 生理食塩水 | − | 6 | 325 ± 14 |
| 試 料 | 5 × 10−6 | 6 | 350 ± 10 |
| 試 料 | 5 × 10−5 | 6 | 345 ± 15 |
| 試 料 | 5 × 10−4 | 6 | 360 ± 20 |
| 試 料 | 5 × 10−3 | 6 | 370 ± 17 |
1−2−9 鎮痛作用
N-アセチルノイラミン酸ナトリウムは0.7%酢酸溶液をマウスの腹腔内投与しておきる、もがき症状を5.9から344.3mg/kg s.c.投与で用量依存の抑制を示す。ED50 48.6mg/kg,ED80 910mg/kgで,対照のアスピリンでは,ED50 46.9mg/kg,ED80 118mg/kgである。
1−2−10 抗炎症作用
N-アセチルノイラミン酸ナトリウムはラットのカラゲニン浮腫に対して1、5、10および 100mg/kg i.v.で用量依存の顕著な抑制作用を示す。
二酸化硫黄暴露ウサギの眼はN-アセチルノイラミン酸ナトリウムの前投与で防げることが明らかになった。
1−3 去痰作用
従来の去痰剤は粘膜溶解、粘膜潤滑、粘液修復などの作用が期待されているものである。しかし、線毛による痰の輸送には、線毛輸送に適した痰の粘度が必要であり、粘度が低くすぎると線毛による輸送が困難となる。このような状態の痰排出困難症の改善には従来、しかるべき薬剤がなく有効な薬剤の開発が望まれていた。8)N-アセチルノイラミン酸ナトリウムはこのような粘性の低い気道分泌液の曳糸性を高め、線毛による輸送を亢進させる作用がある。9)しかも、この化合物は通常人の体内に存在する物質であるから、当然のことながら毒性極めて弱く、マウス、ラット(雌雄)に対する急性毒性LD50(経口、皮下、腹腔)は5,000mg/kg以上でこの値は砂糖と同程度である。臨床第一相試験10)においては1mgから4mgの単回投与で異常なく,次いで3回/日の連続投与を行ない,安全性の問題はないことを確認した。
健康成人の血中には約200ng/mLのN-アセチルノイラミン酸が存在し,尿中には約17mg/日が排出されているから,14mg/日の投与でも尿中の排泄量に変化はみられない。シャウアー教授らの研究によると,N-acetyl-D-[2-14C,9-3H]neuraminic acidをマウスに経口投与して4時間後,90%が腸管で吸収され,6時間後までに投与量の60〜90%が未変化のまま尿中に排泄される。ラットの静脈投与の場合でも10分以内に90%が未変化のまま尿中に排泄されている。11)
ShimonらはN-acetyl-D-[4,5,6,7,8,9-14C]neuraminic acidをマウスに静脈投与して,オートラジオグラフィーを測定した結果,投与後,30分で全ての組織,臓器から放射能が消失するが,尿や腎臓からは比較的高い放射能を観測している。しかし,3時間後には全ての組織,臓器から放射能を検出しなかった。12)
これらの結果から,健康成人に対するN-アセチルノイラミン酸ナトリウムの投与はなんの悪影響も与えないことが分かった。更に,臨床第二相試験を行なって安全性と有効性を検討した結果,粘液硬化作用をもつ去痰薬としての効果が裏づけられた。13)表-19にはその結果をまとめてある。有用率は90.9%におよび,N-アセチルノイラミン酸ナトリウムの粘液硬化作用をもつ去痰薬としての効果が大きく期待され,副作用が無いことと相俟って,その速やかな発売が期待された。
| 例数 | 有用率(%) | ||
| 極めて有用 | 6 | 18.2 | |
| 有用 | 16 | 48.5 | 66.7% |
| やや有用 | 8 | 24.2 | 90.9% |
| 有用とは思われない | 3 | 9.1 | |
| やや好ましくない | 0 | 0 | |
| 好ましくない | 0 | 0 | |
| 極めて好ましくない | 0 | 0 | |
| 計 | 33 | 100 |
先にDavisとDeverell14)は気道の粘液を硬化させる作用をもつ薬剤の開発の必要性を強調しているが,N-アセチルノイラミン酸ナトリウムの効果はすぐれており,目的に適う薬剤の開発に成功したものといえる。関連する各種試験報告は新しい臨床第二相試験、臨床第三相試験を含め、文献欄に一括列挙する。15)
2 免疫を調節してガン転移をおさえるシアル酸誘導体
シアル酸を医薬品の新しい素材としてグリコリポイドの合成を行ったが、数多く合成したシアル酸誘導体のうち、生理活性をもつものについて述べてみたい。16)インフルエンザウイルスが宿主細胞に侵入するとき、最初の付着点はシアリルラクトース部位である。このことからシアリダーゼ活性阻害剤が、インフルエンザの治療.予防剤となるではないかとの発想で多くの研究がなされている。われわれの合成した、部分的にアセチル化したシアリルラクトースやウンベリフェロン誘導体も、その目的をもつものである。キール大学のシャウアー教授との共同研究で、この仕事は行われたが、決定的な結果には至らなかった。シャウアー教授は現在も研究を続けている。前述したようにN-アセチルノイラミン酸ナトリウムは有効な抗去痰薬としての期待が高かったが、現在に至るまで発売の許可が下りていないのは大変残念である。
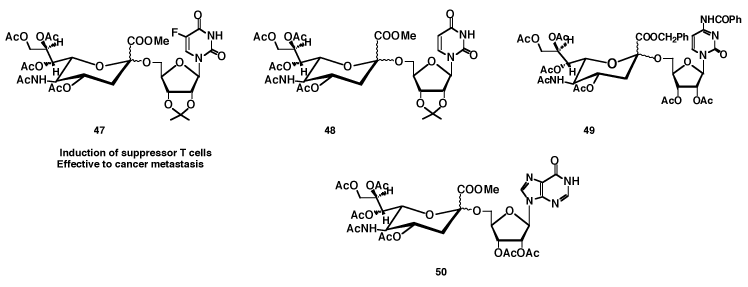
細胞の膜表面にある複合糖質が、細胞の増殖・分化・成熟・神経機能発現などを支配していることは、第5章で述べたとおりである。特に、糖鎖の非還元末端にあるシアル酸は最も重要な生理作用をコントロールしていると言われている。17)我々の合成した変型ヌクレオシドのシアル酸誘導体は、特に、免疫調節作用をもつものが多く存在する。18)(図-20)これらの研究は大澤利昭東京大学名誉教授らによるものである。特に、5-フルオロウラシル誘導体はこの作用が強く、シアル酸転移酵素阻害作用がある。ガラクトースやN-アセチルガラクトサミン転移酵素には作用せず、シアル酸転移酵素にだけ、特異的な阻害作用があるのは面白い。19)
ガンは人類にとって、各種の特効薬が開発された今でも、やはり致命的な病の一つである。外科手術の進歩により、ガン患者の約半数は回復するが、残りの半数は転移によって死亡しているのが現状である。ガンは外科手術によって、ガン組織を除去しても、ガン細胞が単細胞となって体内をめぐり、新しい組織に再び着床して腫瘍を形成することがある。これをガンの転移といい、転移ガンは原発ガンより悪性であることが多いからである。このガン転移をコントロール出来れば、多くのガン患者を救うことが出来る。
ガンの転移は、原発ガンからのガン細胞の遊離、リンパ管や血管への侵入、移動、新しい組織への侵入などの過程を経るものと考えられる。ガン細胞の増殖は個体の免疫能とガン細胞の免疫原性によって左右される。シアリダーゼ処理したガン細胞は移植しにくいことが知られているし、転移においても同様の結果が報告されている。更に、高転移性ガン細胞表面の複合糖質と、低転移性ガン細胞表面の複合糖質とは明らかに異なる。このことは、シアル酸転移酵素が重要な役割を果たしていることを示している。すなわち、ガン転移が活発に行なわれるときは、シアル酸転移酵素活性が2倍に上昇している。非転移ガンではこのような変化は起きない。われわれの合成した変型ヌクレオシドのシアル酸誘導体(図-20)は、いずれも、このシアル酸転移酵素活性を著しく阻害した。特に、5-フルオロウラシル誘導体(47)はこの作用がもっとも強かった。この化合物は、Colon adenocarcinoma 26由来の結腸ガン(NL-17肺転移ガン)のシアル酸転移酵素活性を阻害し、ガン細胞表面のシアル酸量を減らし、肺ガン転移結節を著しく減少させて、生存日数を有意に延長した。また、この化合物は大腸ガンから肝臓ガンへの転移も有意に抑制することが明らかになった。20)
細胞毒性のないこの化合物は一般毒性もなく、ガン細胞に直接の障害を与えるものではないにも関わらず、シアル酸転移酵素活性を阻害し、ガン細胞表面のシアル酸量を減らして、ガン細胞表面糖鎖を正常化し、ガンを治癒する作用があることが分かった。従来の制ガン剤とは根本的に異なる、ガン治療の方向を示すものとして重要である。
3 神経細胞を伸ばすシアル酸誘導体
細胞の分化によって、細胞膜表面の複合糖質の構造が変化することが知られている。シアロシルコレステロール(51a,b)(図-21)を未分化のHL-60細胞に加えると、一次顆粒や核小体が消失して2次顆粒が出来て、細胞が分化する。また、グリア芽細胞の形態を分化することが明らかにされている。21)
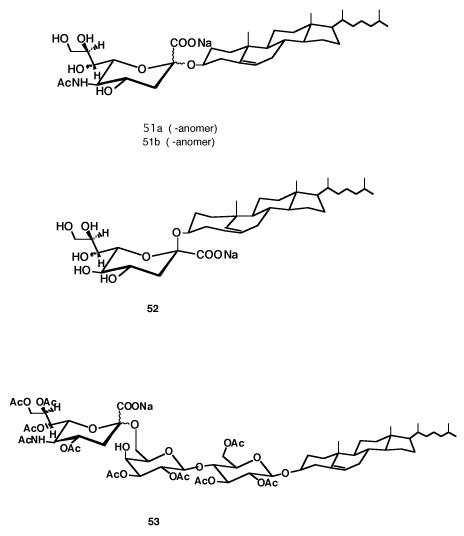
特に、α-シアロシルコレステロール(51a)はマウス神経芽腫瘍細胞(Neuro 2a)に対して強く分化誘導を促進する。その結果、細胞の増殖は減少するが神経突起は伸張する。その強さは、神経成長因子(NGF)の約270倍で、β-誘導体(51b)の27倍より強力である。22)永井教授らの研究によると、シアロシルコレステロール(51a、b)は15分で、細胞核の中へ侵入することが明らかで、(表-24)23)その結果、細胞の遺伝子を活性化し、神経細胞を伸ばす作用を示すのではないかと考えられる。
同様の実験が鶏卵由来のシアリルオリゴ糖ペプチドでも行なわれている。この実験では3H-ラベルしたN-アセチルノイラミン酸を結合したシアリルオリゴ糖ペプチドをラットに経口投与してから,各臓器の放射活性を測定して取り込み量をしらべた結果,経時的に血清への移行が見られた。24)この濃度はN-アセチルノイラミン酸と比較して臓器によってやや異なるが,臓器内滞留時間は長いことが明らかになった。N-アセチルノイラミン酸自身やシアリルオリゴ糖ペプチドが,経口投与で脳,血清,腸など多種の臓器に移行することが明らかとなり,ムチンなどのシアリルオリゴ糖ペプチドの生理活性機能の説明に重要な根拠を与えるものである。
α-シアリルコレステロール(51a)はアルツハイマー型痴呆と機能障害が類似するモデルマウスを用いて実験した結果、1日に1回、3mg/kgを7日間、経口投与すると、明らかに改善されることが分かった。25)このように、経口投与で神経細胞を活性化するのに有効な薬物は従来のアルツハイマー型痴呆の薬剤とは、全く異なるタイプのアルツハイマー型痴呆や交通事故などの神経障害の治療薬の開発を予測させるものである。
コレステロールをKDN(19)に結合した化合物(52)やGM3に結合した化合物(53)など(図-21)も同様の生理活性を示すから、この系統の誘導体から面白い医薬品が開発されるであろう。26)ここで用いた“グリコリポイド”(Glycolipoid)という用語は、非天然型グリコリピド総称名として、1986年のシアル酸研究会で提案したもので、27)章の初めにも利用している。ご愛用をお願いする次第である。
4 インフルエンザの妙薬
著者らはすでにシアル酸研究の当初から研究目的の一つにしていたものに、インフルエンザの薬としてシアリルラクトースの部分アセチル化誘導体の利用がある。28)このことはすでに触れたことであるが,インフルエンザウイルスとシアリルラクトース部分の結合がヘマグルチニンを仲介して行なわれることは古くから知られていたから,29)この作用を利用するとインフルエンザの治療と予防が可能になるわけである。1961年にはすでに燕窩ムコイドが各種のインフルエンザウイルスのノイラミニダーゼに活性で,血液に対する抗体は持たないことを報告されている。30)このことは燕窩ムコイドには糖脂質を含まないことを示している。1986年、著者がキール大学を訪れてシャウアー教授とディスカッションしたとき,シアリルラクトース部分とインフルエンザウイルスとの結合はシアル酸部分の部分アセチル化誘導体の合成によって解決できると結論した。
うまく行けば,インフルエンザの治療薬や予防薬が可能だし,駄目でもインフルエンザウイルスの型判定のための簡単な試薬になるはずである。
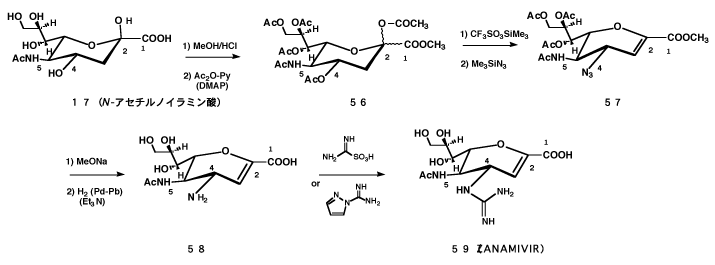
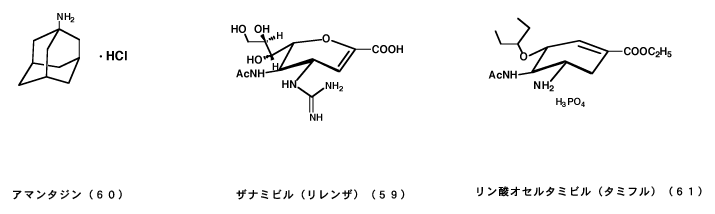
いずれにしても最も新しく、最も興味のあるインフルエンザの治療薬はシアル酸の誘導体である。その後、英国のグラクソグループの国際的な共同研究によって4-アミノ-2,3-デオキシ誘導体や4-グアニジノ-2,3-デオキシ誘導体が合成され、31)強力なシアリダーゼ活性阻害作用を利用したインフルエンザの治療薬(ザナミビル)として開発された。32)300報をこえる論文があるが、ここには合成法を簡単に図示するにとどめる。
この研究はオーストラリア,イギリス,アメリカの世界中を網羅した総合チームで行なわれ,しかも,インフルエンザウイルスとシアリルラクトースの結合体をモデルにしたコンピューターグラフィックスを用いて,作りだされた分子モデルを基礎にしている。ザナミビル(商品名リレンザ)はすでに日本をふくむ世界各国で使用されている。多くの関連論文は新しい抗ウイルス薬の方向を示唆するもので一連の研究はノーベル賞に値するものである。
作用機序の特異な点はインフルエンザA型およびB型ウイルスの増殖段階に必要なノイラミニダーゼを阻害して,新しい細胞への感染を防御することにある。この作用は従来のインフルエンザ治療薬と全く異なる画期的なものである。最近のインフルエンザ流行の兆しに対してアマンタジン33)の使用が推奨されているが,その作用点はウイルスのM2タンパク質であるため,M2タンパク質をもたないインフルエンザであるB型ウイルスには無効である。ザナミビルは毒性も少なく,吸入して有効な薬剤で、新型インフルエンザの治療・予防に有効である。
「ザナミビル[zanamivir]」をモデルにして開発された「リン酸オセルタミビル[oseltamivir]」は全く同じ機構でインフルエンザの予防・治療に有効である。特に、後者は経口内服薬として「タミフル」の商品名で販売されている。34)その意味で利便性がたかく、国は新型インフルエンザの流行を阻止するために、相当量の「タミフル」を備蓄するという。大変結構なことだ。
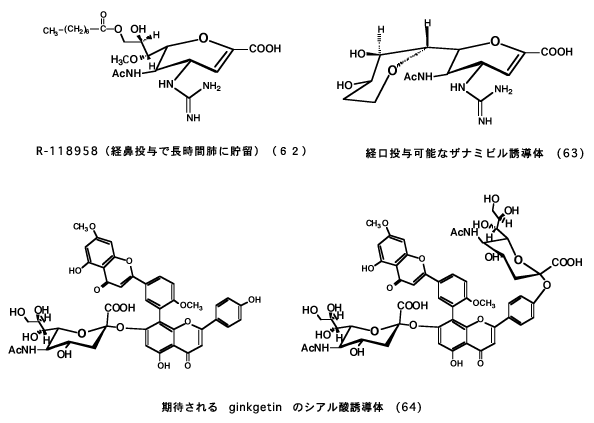
最近では、ザナミビルを更にデザインして、より強力な長鎖アルキルエステルプロドラッグ型シアリダーゼ阻害剤(62)や、経口投与が可能でタミフルと同程度のウイルス感染阻害活性のある化合物(63)などが作られている。35)また、ビフラボノイドのシアル酸誘導体(64)が強いシアリダーゼ阻害活性を示し、新型のインフルエンザ治療薬の開発が期待されている。36)
文献・注
- 1) 木歩士亘之,西山真理子,久我哲郎,石井隆幸,仮屋勝秀,小笠原定則,応用薬理,39(5), 457-472 (1990).
- 2) N. Sugiyama, K. Saito, M. Goto, H. Mizu, K. Tomita, H. Takayanagi, H. Ogura, “Crystal Structure of Sodium N-Acertylneuraminate Trihydrate”, Anal. Sciences, 5, 491-492 (1989).
- 3) K. Saito, K. Sugai, K. Fujikura, N. Yamada, M. Goto, C. Ban, E. Hayasaka, N. Sugiyama, K. Tomita, Carbohydr. Res., 185, 307-314 (1989).
- 4) N. Sugiyama, K. Saito, K. Fujikura, K. Sugai, N. Yamada, M. Goto, C. Ban, E. Hayasaka, K. Tomita, Carbohydr. Res., 212, 25-36 (1991).
- 5) V. Pozsgay, H. Jennings, D. L. Kasper, Eur. J. Biochem., 162, 445-450 (1987).
- 6) 小笠原定則,花房孝,仮屋勝秀,伊藤正善,志鳥善保,特許公報,昭3-28411,75-86 (1988).
- 7) a) 畑中恭子、中嶋典子、花房孝、三富守、小笠原定則、基礎と臨床、21(6), 137-141 (1987);急性毒性 LD50 経口、皮下、腹腔;マウス、ラット(雌雄)5,000mg/kg 以上;b) 高橋敦子、花房孝、三富守、小笠原定則、基礎と臨床、21(6), 142- 146 (1987); 急性粉体吸入毒性:LC50 1時間暴露;14日観察 ラット(雌雄) 4,000mg/m3 以上;c) 緑川宏子、野本幸正,山本肇,花房孝、三富守、小笠原定則、基礎と臨床、25(3), 5-10 (1991);急性毒性:LD50 静脈 マウス、ラット(雌雄)、ビーグル犬(雄)5,000mg/kg以上.
- 8) 長岡滋、臨床喀痰学、41、ライフサイエンス(1984).
- 9) a) 長岡滋、中村清一、梅原由美子、近藤光子、山中栄一、仮屋勝秀、木歩士亘之、Ther. Res., 5, 83-92(1986), Neu5AcNa の去痰作用についての研究ーIn Vitro Studyー, カエルの口蓋粘膜線毛のMTR、顕微鏡で計測した粘液上の微粒子状の炭粉の1分間あたりの移動距離(mm)測定; b) N. Sugiyama, K. Saito, H. Mizu, M. Ito, Y. Nagai, Anal. Biochem., 170, 140-144 (1988), A high-precision selective determination method for free N-acetylneuraminic acid in human serum; c) F. Ojima, T. Ido, T. Takahashi, J. Hatazawa, M. Ito, H. Sasaki, M. Yanai, T. Aikawa, T. Takishima, K. Abiko, M. Amano, Annals of Nuclear Medicine, 3(3), 143-147 (1989), N-アセチルノイラミン酸ナトリウム微粉末を2-デオキシ-2-[18F]フルオログルコースでコーテイングした薬物をビーグル犬に投与、PET試験;d) 玉置淳、小林健司、堀井さつき、近藤光子、滝沢敬夫、Ther. Res., 10, 265-269 (1989) 、家兎培養気道上皮細胞の線毛運動に対する影響、気道粘膜上皮の線毛運動能に及ぼす影響を検討するため,家兎気管培養線毛細胞を用い,photoelectric法によって線毛運動周波数を測定、線毛運動周波数は濃度依存性に増大し,同濃度のcarbocisteineやambroxolに比し強力;e) 伊藤清隆,安藤正幸,荒木淑郎,石井隆幸,甲斐広文,宮田健,Ther. Res., 10(2), 683-691 (1989) , f) 長岡滋、中村清一、三上正志、小関隆、野口英世、鈴木一、田中一正、小田切統二、臨床医薬、7(5), 1099-1114 (1991)、痰の物理・化学的性状および線毛による輸送性と自覚症状との関連性についての研究; g) 滝沢敬夫,可部順三郎,工藤宏一郎,有岡宏子,鵜沢毅,三島秀康,工藤翔二,岡村樹,毛利昌史,木野博至,中村雅夫,千代谷厚,臨床医薬,7(5), 1137-1145 (1991), 肺気腫に対する臨床試験ー第三相一般臨床試験による成績ー,中程度改善以上 47.6%, 軽度改善 85.7%, 有用 47.6%;h) 長岡滋、野口英世、鈴木一、田中一正、秋澤孝則、真野健次、野本日出男、佐野靖之、田中健彦、中村清一、三上正志、小関隆、臨床医薬、7(6), 1347-1372 (1991)、Bronchorrhea様の病態を示す慢性呼吸器疾患患者の痰の喀出困難に関する自覚症状の改善、吸入療法開始後に、痰の動的弾性率増加、喀痰中のアルブミン濃度減少、有用性あり;i) 佐藤篤彦,渡辺孝芳,青木秀夫,本多淳郎,本田和徳,立花昭生,谷口正実,秋山仁一郎,岡野博一,岡野昌彦,松原環.岸本肇,白井敏博,川勝純夫,臨床医薬,7(7), 1597-1606 (1991), 慢性呼吸器疾患に対する長期投与時の臨床評価,中程度改善 68.6%, 有用 74.3%; j) 川合満,栗原直嗣,平田一人,坂東憲司,橋爪誠,杉田實,北田修,Ther. Res., 12(5), 479-489 (1991), 去痰困難を訴える気管支喘息患者に対する臨床効果,著しく改善 6.7%, 中程度改善 46.7%, 軽度改善 60.0%;k) 長岡滋、螺良英郎、原沢道美、近藤有好、中山正、小田切統二、三上正志、小川暢也、大崎尭、三上洋、佐々木英忠、会川尚志、土屋俊晶、江部達夫、北村諭、石井芳樹、坂東政司、滝沢弘隆、須田明、木田厚端、神野悟、野村洪一郎、宍戸春美、坂本恵里子、高橋篤、村井容子、川上雅彦、中村清一、佐藤篤彦、早川啓史、末次勤、佐藤元彦、伊藤正己、山中正彰、岡森仁昭、池田総之、副島林造、沖本二郎、山木戸道郎、石岡伸一、保澤総一郎、河野誠也、石橋凡雄、北原義也、安藤正幸、伊藤清隆、直江弘昭、本田泉、江頭洋祐、臨床医薬、10(10), 2233-2251 (1994), 慢性呼吸疾患患者の去痰に対する有用性の検討、プラセボを対照薬とした二重盲検群間比較試験.
- 10)中島光好,金丸光隆,杉山直和,斉藤謹一,臨床医薬,3(7), 827-845 (1987).
- 11)U.Nohle, R.Schauer, Hoppe-seyler's Z. Physiol. Chem., 362, 1495-1506 (1981).
- 12)R.Shimono, M. Watanabe, N. Kuno, T. Kihara, Acta Histochem. Cytochem., 17, 259-268 (1984).
- 13)長岡滋,螺良英郎,滝沢敬夫,岡安大仁,堀江孝至,米田良蔵,若井安理,中村清一,中島重徳,長坂行雄,智片英治,伊藤正己,臨床医薬,3(8),923-948 (1987).
- 14)S.S.Davis, L.C.Deverell, Mod. Probl. Paediatr., 19, 207-217 (1977).
- 15)a) 緑川宏子,花房孝,三富守,小笠原定則, 基礎と臨床、21(6), 147-151 (1987), 微生物遺伝子復帰突然変異試験, S. typhimurium TA100, TA1535, TA98, TA1537; E. coli WP uvr A- 5菌株で誘発突然変異株数の上昇なし; b) 畑中恭子,花房孝,三富守,小笠原定則,基礎と臨床、21(6), 153-163 (1987), ウサギ眼粘膜一次刺激性試験・皮膚一次刺激性試験, 粉末:眼粘膜に対する刺激性は非洗眼群、洗眼群ともに minimally irritating, 溶液:10% nonirritating, 20%; 40% practically nonirritating;c) T. Miyata T. Ishii, N. Sugiyama, Y. Okano, N. Nishi, K. Takahama, S. Ogasawara, Y. Oda, K. Yokoyama, Y. Murata, H. Kai, Arch. intern. de Pharmaco. et Therapy, 304, 277-289 (1990), Effect of N-Acetylneuraminic Acid on Respiratory Tract Secretion and Inflammation in the Bronchitic Rabbit;d) 高橋敦子、野本幸正,花房孝、三富守、小笠原定則、基礎と臨床、25(3), 12-39 (1991), 粉体吸入毒性: 1日1時間、週7日 ラット(雌雄),予定臨床用量4mg/50kg/day.最高値300倍を設定.4週間の吸入試験と4週間の回復試験を行い、影響がないことを確認; e) 宇井敏博,畑中恭子,緑川宏子,花房孝,三富守,小笠原定則, 基礎と臨床、25(3), 41-62 (1991), ミスト吸入毒性,1日3回、週7日、2.4,8% (w/v) 1分間/10kg,ビーグル犬(雌雄),予定臨床用量4mg/50kg/day,最高値600倍を設定,4週間の吸入試験と4週間の回復試験を行い、影響がないことを確認; f) 高橋敦子、今関千枝子,山下博久,山本肇,花房孝、三富守、小笠原定則、基礎と臨床、25(3), 64-105 (1991),6ヵ月反復粉体吸入毒性,1日1時間、週6日暴露6ヵ月、休薬3ヵ月,ラット(雌雄); g) 宇井敏博,畑中恭子,斉藤富貴子,山本肇,花房孝,三富守,小笠原定則,基礎と臨床、25(3), 107-130 (1991), 6ヵ月反復ミスト吸入毒性,1日3回、週6日、6ヵ月、休薬3ヵ月, 90mg/kg/day/体重10kg当たり 2分間, 10、30mg/kg/day, 1分間, ビーグル犬(雌雄); h) 宇井敏博,畑中恭子,三浦美代子,花房孝,三富守,小笠原定則,基礎と臨床、25(3), 131-144 (1991), 生殖・発生毒性,粉体吸入 125、250、500mg/m3,ラット(雌雄)および胎児にたいして変化なし, 妊娠前、初期; i) 田中憲夫,竹内ゆかり,花房孝,三富守,小笠原定則,基礎と臨床、25(3), 145 - 163 (1991), 生殖・発生毒性, 粉体吸入 125、250、500、1000mg/m3 1日1時間、妊娠7〜17日(11日)連続暴露, ラット(雌雄)胎児、出生児 異状なし;j) 田中憲夫,竹内ゆかり,花房孝,三富守,小笠原定則,基礎と臨床、25(3), 165-172 (1991), 生殖・発生毒性, 粉体吸入 10、30、90mg/kg/day 体重3kgあたり1分間, 妊娠6〜18日(13日)連続暴露, ウサギ(雌雄)胎児 異状なし(90mg; 常用量の1125倍);k) 田中憲夫,能代順子,角田和仁,花房孝,三富守,小笠原定則,基礎と臨床、25(3), 173-188 (1991), 周産期・授乳期試験, 粉体吸入125、250、500 mg/m3, ラット(雌雄)母動物および出生児に異状なし; l) 花房孝,三富守,小笠原定則,基礎と臨床、25(3), 199-203 (1991), 哺乳類の培養細胞染色体の異状試験, チャイニーズ・ハムスター肺腺維芽細胞由来のCHL株細胞, 直接法、代謝活性化法ともに倍数性細胞の出現率異状なし; m) 山本仁,柳本行雄,花房孝,三富守,小笠原定則,基礎と臨床、25(3), 205-208 (1991),マウスの小核試験, 500、1000、2000mg/kg腹腔内注射(陽性対照群はマイトマイシンC),多染性赤血球(PCE) の出現頻度0.22%(対照5.12%);n) 小嶋文良、井戸達雄、高浜和夫、甲斐広文、篠原寛、石井隆幸、小笠原定則,宮田健、基礎と臨床、25(6), 1720-1724 (1991), 新気道クリアランス測定法を用いた去痰作用の検討、Evans blue吸入法で気道のクリアランス測定可能、去痰薬の薬効評価法に応用可能.
- 16)小倉治夫、薬学雑誌、114, 277-303 (1994). 引用文献と注を参照。
- 17)M. V. Itzstein, W. -Y. Wu, G. B. Kok, M. S. Pegg, J. C. Dyason, B. Jin, T. V. Phan, M. L. Smythe, H. F. White, S. W. Oliver, P. M. Colman, J. N. Varghese, D. M. Ryan, J. M. Woods, R. C. Bethell, V. J. Hotham, J. M. Cameron, C. R. Penn, Nature (London), 363, 418-423 (1993); 須田、“複合糖質の化学と応用”、小倉治夫監修、㈱シーエムシー、東京、1989, p. 64.
- 18)I. Kijima, K. Ezawa, S. Toyoshima, K. Furuhata, H. Ogura, T. Osawa, Chem. Pharm. Bull., 30, 3278-3283 (1982); 小倉治夫、古畑公夫、大澤利昭、豐島聰、志鳥善保、木嶋功, 日特、昭 58-72599, 879 (1983); I. Kimima-Suda, S. Toyoshima, M. Itoh, K. Furuhata, H. Ogura, T. Osawa, Chem. Pharm. Bull., 33, 730-739 (1985).
- 19)I. Kijima-Suda, Y. Miyamoto, S. Toyoshima, M. Itoh, T. Osawa, Cancer Res., 46, 858-862 (1986); 豐島聰、大澤利昭、Oncologia, 13, 13 (1985).
- 20)P. Thomas, B. E. Harvey, H. E. Wagner, C. A. Toth, N. Zamcheck, G. Steele, A.A.C.R., 31 (814), 70 (1990); B. E. Harvey, N. Zamcheck, G. Steele, P. Thomas, ibid., 32 (373), 63 (1991).
- 21)T. Kato, J. Ito, R. Tanaka, Y. Suzuki, Y. Hirabayashi, M. Matsumoto, H. Ogura, K. Kato, Brain Res., 438, 277-285 (1988); 斉藤政樹、がん・バイオサイエンスニュース、88-2, 12-19 (1988).
- 22)永井克孝、伊藤正善、志鳥善保、小倉治夫、日特、昭 62-265229, 217-225 (1987);小倉治夫、古畑公夫、佐藤慎吾、伊藤正善、志鳥善保、日特、昭 63-63697, 807-814 (1988); S. Tsuji, T. Yamashita, M. Tanaka, Y. Nagai, J. Neurochem., 50, 414-423 (1988);永井克孝、伊藤正善、志鳥善保、小倉治夫、日特、平 1-93529, 187-191 (1989).
- 23)Y. Yamashita, S. Tsuji, Y. Nagai, Glycobiology, 1, 149-154 (1991); 永井克孝、山下達朗, 田中誠、小倉治夫、日特、平 3-292883, 517-532 (1991);
- 24)纐纈守,中田勝康,仁戸田輝彦,瀬古玲,ジュネジャ,金武祚,山本武彦, 第15回糖質シンポジウム,106-107(1993).
- 25)伊藤忠信、小笠原定則、小倉治夫、日特、平 3-81287, 981-985 (1991); 小笠原定則, 仮屋勝秀、田中誠、中村光延、小倉治夫、日特、平 3-255092, 933-941 (1991).
- 26)小倉治夫、Bio industry, 9, 45-52 (1992); 小倉治夫、鈴木和夫、古畑公夫、田中誠、日特、平 3-161496, 753-768 (1991).
- 27)H. Ogura, Frontiers of Glycoconjugate Research, The 2nd International Meeting of Sialic Acids Society, Oct. 13, 1986.
- 28)H. Ogura, K. Furuhata, S. Sato, K. Anazawa, M. Itoh, Y. Shitori, Carbohydr. Res., 167, 77-86 (1987).
- 29)J. Haverkamp, R. Schauer, M. Wember, J. F. G. Viegenthart, Hoppe-Seyler's Z. hysiol. Chem., 356, 1575-1583 (1975); R. Schauer, Methods Enzymol., 50, 64-89 (1979);鈴木康夫,安藤進,“生物化学実験法 35,ガングリオシド研究法 I, II”㈱学会出版センター,東京,1995.
- 30)C. Howe, L.T. Lee, H. M. Rose, Archives of Biochemistry and Biophysics, 95, 512-520 (1961). [Collocalia Mucoid: A substrate for myxovirus neuraminidase]
- 31)Zanamivir "Antiviral Influenza Neuraminidase Inhibitor", Drugs of the Future, 1996, 21(4), 375-382; 合成法 G.B. Kok, M.von Itzstein. Carbohydrate Res., 302, 237-240 (1997); C.U. Kim, W.Lew, M.A. Williams, H. Liu, L. Zhang, S. Swaminathan, N. Bischofberger, M.S. Chen, D.B. Mendel, C.Y. Tai, W.G. Laver, R.C. Stevens, J. Am. Chem. Soc., 1997, 119, 681-690; D.B. Mendel, C.Y. Tai, P.A. Escarpe, W. Li, R.W. Sidwell, J.H. Huffman, C. Sweet, K.J. Jakeman, J. Merson, S.A. Lacy, W. Lew, M.A. Williams, L. Zhang, M.S. Chen, N. Bischofberger, C.U. Kim, Antimicorob. Agents Chemother., Mar. 1998, 640-646; W. Li, P.A. Escarpe, E.J. Eisenberg, K.C. Cundy, C. Sweet, K.J. Jakeman, J. Merson, W. Lew, M. Williams, L. Zhang, C.U. Kim, N. Bischofberger, M.S. Chen, D.B. Mendel, Antimicorob. Agents Chemother., Mar. 1998, 647-653; 松本慶蔵,化学療法の領域,12(5), 902-909 (1996); 出石通博,五味田裕,医薬ジャーナル, 33, 168-173 (1997).ここでは代表的なものだけをあげるに止める。
- 32)藤原将寿、木下美弥、MEDCHEM NEWS, 14(1), 16-21 (2004).
-
33)従来使用されている脳代謝改善薬のドパミン系賦活剤としてパーキンソン症候群の治療薬として知られる塩酸アマンタジンが、A型インフルエンザウイルス感染症に有効であることがわかり効能が追加された。塩酸アマンタジンは特殊なアダマンタン構造をもつ医薬品で、(図-23)A型インフルエンザウイルスの感染初期にウイルスの脱殻を阻害して、リボヌクレオプロテインを細胞核内へ輸送する段階を阻止すると考えられている。アマンタジンは元来、抗ウイルス剤として開発されたもので、A型インフルエンザウイルスに対しては予防効果もあり、有益な医薬品であるがB型インフルエンザには無効であるうえ、高度耐性ウイルスの出現が早いので、使用は老人と幼児に限定すべきである。早ければ治療開始後2〜3日で耐性ウイルスが発現し、その感染では回復がおくれるとの報告もある。予防薬としても有効であるとの報告があるが、反面、無効との報告もある。シアル酸誘導体の活用が望まれる。
菅谷憲夫、インフルエンザ対策、日本醫事新報、3900、37-43 (1999); F.G. Hayden, R.B.Belshe, R.D.Clover, A.J.Hay, MG.Oakes, W.Soo, Emergence and apparent transdmission of rimantadine-resistant influenza A virus in families, N. Engl. J. Med., 321, 1696-1702 (1989). - 34)菅谷憲夫、からだの科学、210,32-35 (2000).
- 35)本田雄、GlycoTOKYO 2003 (2003).
- 36)H. Yamada, T. Nagai, K. Takahashi, 国際特許 (2004), Inhibition of Influenza Virus Sialidase and Antiinfluenza Virus Activity by Plant Flavonoids; T. Nagai, Y.Miyaichi, T.Tomimori, Y.Suzuki, H.Yamada, Chem. Pharm. Bull., 38, 1329-1332 (1990).