シアル酸の科学
古代の霊薬、シアル酸
- 第2章 燕窩の成分
- 1 燕窩の成分
- 2 燕窩を構成する糖鎖
- 3 燕窩を構成するタンパク質
- 4 燕窩のシアル酸
- 文献・注
第2章 燕窩の成分
1 燕窩の成分
天然の燕窩は表1に示す成分からなり、加水分解すると17.36%の還元糖を含み、タンパク質の成分は表2に示すとおりで約60%に達する。中薬大辞典1)によると、中性糖はほとんどがガラクトースで、ついでグルコース、マンノースでその比率は15:2:1となっているが、グルコースの存在は疑問である。2)ガラクトースはムチン型(O-型)糖タンパク質と考えられるが、マンノースの存在は複合型アスパラギン結合型(N-型)糖タンパク質の存在を示唆するものである。
| 天然燕窩 | 成分(%) |
| 水分 | 10.40 |
| 窒素化合物 | 57.4 |
| 無窒素抽出物 | 22 |
| 繊維質 | 1.4 |
| 脂肪 | 微量 |
| 灰分 | 8.70(2.52)* |
* 毛を除去したもの
リン:0.035% 硫黄:1.10% その他:カルシウム、カリウムを含む
| 窒素分布 | 成分(%) |
| アミド態窒素 | 10.08 |
| フミン窒素 | 6.68 |
| アルギニン窒素 | 19.35 |
| シスチン窒素 | 3.39 |
| ヒスチジン窒素 | 6.22 |
| リジン窒素 | 2.46 |
| モノアミノ態窒素 | 50.19 |
| 非アミノ態窒素 | 7.22 |
糖タンパク質には大きく分けてO-型糖タンパク質とN-型糖タンパク質との2種類がある。(シアル酸 ―現代新薬の創製まで― 第2章参照)O-型糖タンパク質はムチン型糖タンパク質とも呼ばれ唾液や胃や腸の粘膜からの分泌物として、あるいはある種のホルモンとして分泌される。糖鎖は短く、タンパク質のセリンやトレオニンの酸素に結合している。糖鎖の末端にはシアル酸が結合する場合が多く、例えば、胃粘膜ではこのムチンが胃壁を守っているのである。胃液は強酸性であるとともに強力な消化酵素があるから、ムチンが無ければ胃壁は直ちに消化されて穴があいてしまうであろう。また、唾液は細菌感染の防御役としても大きい働きをしている。すなわち、細菌はレクチンを介してムチン型糖鎖に結合するから、その働きを封じられる訳である。
このようにムチン型タンパク質には、細胞表面の保護、消化酵素から消化管の保護、細菌やウイルス感染からの保護などの作用がある。そのためにはムチン型タンパク質の種類は多いほうがよいから、例えば、白血球膜のムチン型タンパク質で代表的なロイコシアリンには約80個のムチン型タンパク質が結合している。白血球のシアル酸量の約85%がこのロイコシアリンに結合していて、細胞増殖、細胞接着などなどの重要な働きをしている。3)燕窩はこのようなムチン型タンパク質の固化したものが主体となっているから、当然健康維持に大変有用な働きが期待できる。4)
N-型糖タンパク質には3種の別があって、いずれもマンノースを含み複雑で長い糖鎖がタンパク質のアスパラギンに結合しているのでムチンに対して、アスパラギン結合型糖鎖とも呼ばれる。N-型糖タンパク質は糖脂質とともに、複雑な生命現象の中心を担うものの一つで、ホルモンや酵素など細胞相互の連絡係と考えられる作用を果たしている。5)
2 燕窩を構成する糖鎖
HanishとUhlenbruckの研究によると、6)燕窩の糖鎖はL-フコース、N-アセチルノイラミン酸、ガラクトース、マンノース、N-アセチルガラクトサミン、N-アセチルグルコサミンでその比率は1:17:29:3:17:13である。微量の L-フコースやマンノースを含むことから、燕窩の糖タンパク質にはN-型糖タンパク質(I-グループ)の存在を否定出来ない。おそらく、絨毛に由来するものであろう。表-3からも分かるようにI-グループの糖組成はマンノース、N-アセチルグルコサミン、ガラクトースの比率が3:4:8である。この値はI-グループがN-型糖タンパク質 であることを示すものである。
燕窩抽出エキスの精密なHPLC分析によると、マンノース、N-アセチルガラクトサミン、N-アセチルグルコサミン、ガラクトースの比率が、4N塩酸分解では1:14:25:43で、2N塩酸分解では1:6.5:9.8:25であることからも、全体としてムチン型糖タンパク質からなることがわかる。しかし、この場合もマンノースを含むこと、また、後述のアミノ酸分析でアスパラギンをある程度検出していることから、N-型糖タンパク質を含むことがわかる。全体としてはO-型糖タンパク質の方が多く(II〜VII)、その構造は多くの研究者によって明らかにされた。
| グループ | A | B | I | II | III | IV | V | VI | VII |
| L-Fuc | 0.02 | 0.02 | 0.1 | - | - | - | - | - | - |
| D-Man | 0.06 | 0.09 | 3 | 0.1 | - | - | - | - | - |
| D-Gal | 0.57 | 0.56 | 7.8 | 3 | 3.0(3) | 2.0(2) | 2.0(2) | 1.0(1) | 1.0(1) |
| D-Glc | - | - | - | - | - | - | - | - | - |
| D-GalNAc-ol | - | - | - | 0.9 | 0.9(1) | 0.9(1) | 0.6(1) | 0.8(1) | 0.4(1) |
| D-GalNAc | 0.33 | 0.09 | |||||||
| D-GcNAc | 0.25 | 0.24 | 4.3 | 1.6 | 1.9(2) | 2 | 0.9(1) | 0.9(1) | 0.2(-) |
| NeuAc | 0.34 | 0.07 | - | - | - | - | - | - | - |
[mol/g] [molar ratios relative to the value printed in bold face type]
O-型糖タンパク質の複雑な構造はWieruszeski, Egge7)やStrecker8)ら多くの科学者の研究で明らかにされた。すなわち、これらの糖鎖構造の決定にあたっては、燕窩をまず塩酸で処理してから硼素化水素ナトリウムで還元的に分解して得られる糖鎖をゲルクロマトグラフィー、HPLC、薄層クロマトグラフィー、ペーパークロマトグラフィーなどを繰り返して精製して、中性糖、モノシアロ糖 、ジシアロ糖を得た。7,8)更にメチル化して、FAB-MAS, EI-MAS, NMR(500Mhz), multiple-Relay-Cosyと1H/13C chemical-sift-correlated 2-Dなどの最新の分析機器を駆使して行われた。8)
その基本構造はGal-GalNAc-セリンあるいはトレオニンで、糖鎖の非還元末端にN-アセチルノイラミン酸が結合しているのが燕窩ムチンの特色である。糖鎖構造は次の10種類である。
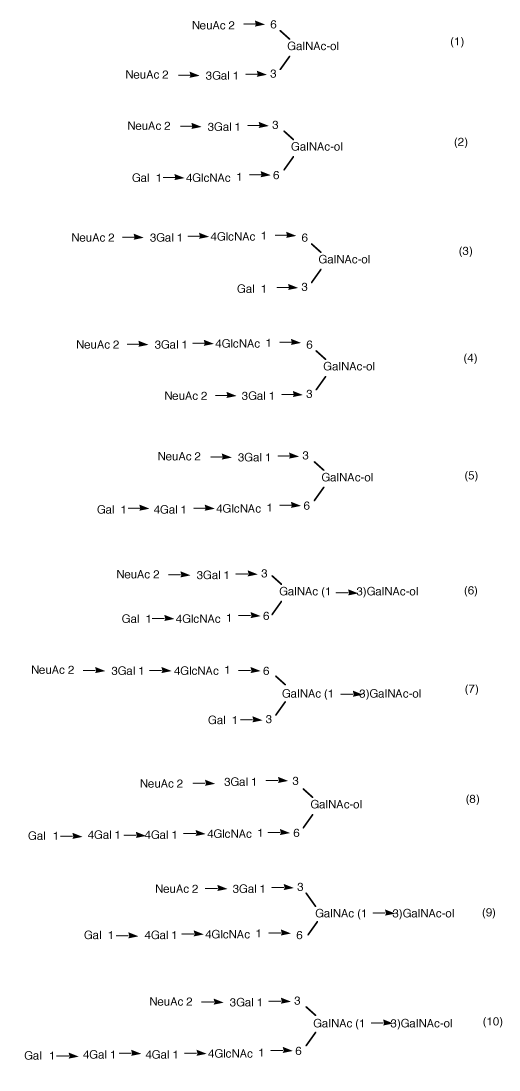
牛乳の糖鎖はラクトース型であるから大きく異なるが、鶏卵の卵白では、オボムチンと呼ぶO-型糖タンパク質(セリン結合型)で、糖鎖部分の構造は燕窩のそれに類似する。その内の2個は同じものであることがわかっている。燕窩の糖鎖に比べて比較的簡単なシアロ糖鎖で、8)次に構造式を掲げるが、当然のことながら、タンパク質部分の構造はことなる。
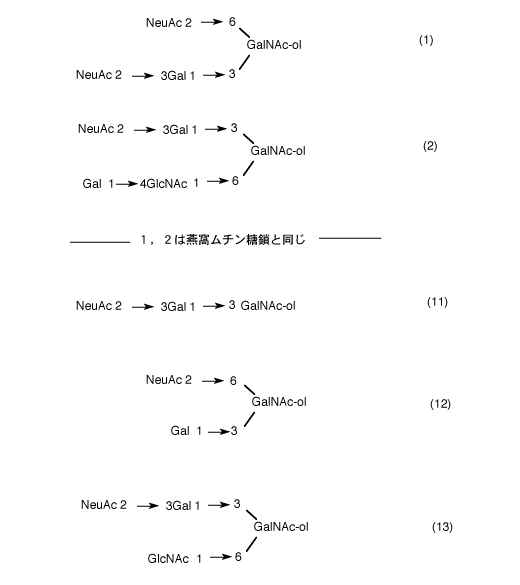
3 燕窩を構成するタンパク質
KathanとWeeks9)の研究によると表に示すように塩酸加水分解の条件を24時間と48時間に設定してアミノ酸分析を行っている。この結果は追試験を行って確かめられている。10)
| アミノ酸 | mmoles / 100 mg sample | |
| 24 hr* | 48 hr* | |
| Aspartic acid | 20.6 | 19.7 |
| Threonine | 21 | 19.8 |
| Serine | 30.4 | 27.9 |
| Glutamic acid | 21.2 | 20.4 |
| Proline | 25.2 | 23.6 |
| Glycine | 19.2 | 18.2 |
| Alanine | 11.8 | 14.5 |
| Valine | 20 | 19.8 |
| Methionine | 0.4 | 0.8 |
| Isoleucine | 7.3 | 7.6 |
| Leucine | 15.6 | 16.5 |
| Tyrosine | 6.2 | 9 |
| Phenylalanine | 9 | 8.9 |
| Lysine | 7.3 | 7.2 |
| Histidine | 5.2 | 5.2 |
| Arginine | 12.8 | 11.1 |
| 1/2 Cystine | 3.8 | 3.4 |
| total | 237 | 233.6 |
* Hours of hydrolysis with constant boiling HCl at 108℃
燕窩から直接、シアル酸糖鎖を残したまま、ムチン型糖タンパク質を取り出して有効利用しようという研究がなされた。(未発表)10)これは燕窩をプロテアーゼ処理して水溶性とするもので、この方法で処理した燕窩の抽出物は主にムチン型糖タンパク質で、約60%のムチン型タンパク質と、約40%のN-型糖タンパク質からなり、それぞれ約10%の中性糖とシアル酸から構成されている。
含有するシアル酸はすべて結合型で、遊離シアル酸を含まないことは限外ろ過法で確認され、また、プロテアーゼ処理したにも関わらず、燕窩はペプチドへの細分化はなされておらず、ゲルろ過法による分子量は約10万である。ケールダール法による分析では粗タンパク質は平均約50%で、アミノ酸分析の結果は表(その2)のとおりである。
| アミノ酸 | 燕 窩 | 可溶性抽出糖タンパク質 | ||
| % | mg/100g | % | mg/100g | |
| Asx* | 9.55 | 3,574 | 9.33 | 4,788 |
| Thr | 5.39 | 2,018 | 7.19 | 3,688 |
| Ser | 6.97 | 2,610 | 8.4 | 4,307 |
| Glx | 7.9 | 2,957 | 7.95 | 4,080 |
| Gly | 4.51 | 1,688 | 3.8 | 1,948 |
| Ala | 3.59 | 1,343 | 2.84 | 1,459 |
| Cys | 1.39 | 519 | 2.78 | 1,425 |
| Val | 6.84 | 2,561 | 6.77 | 3,474 |
| Met | 0.39 | 145 | 0.4 | 205 |
| Ile | 4.43 | 1,658 | 4.69 | 2,408 |
| Leu | 9.03 | 3,382 | 8.87 | 4,548 |
| Tyr | 3.92 | 1,469 | 6.54 | 3,355 |
| Phe | 5.91 | 2,211 | 5.45 | 2,794 |
| Lys | 3.66 | 1,368 | 2.94 | 1,508 |
| NH3 | 8.51 | 3,187 | 3.67 | 1,882 |
| His | 2.95 | 1,103 | 3.18 | 1,633 |
| Arg | 7.08 | 2,649 | 6.72 | 3,447 |
| Pro | 7.99 | 2,992 | 8.47 | 4,342 |
| 計 | 100 | 37,434 | 100 | 51,291 |
* アスパラギン、アスパラギン酸を含む
その結果から見ると、ムチン型糖タンパク質を構成するセリン、トレオニンの含量は燕窩で12.4%、抽出物で15.6%存在する。これに対してアスパラギン糖タンパク質(N-型)はそれぞれ、最大で9.6、9.3%となっている。それぞれの糖タンパク質の含量を示すものといえる。
4 燕窩のシアル酸
燕窩を食品素材としてみると、プロテアーゼで酵素分解して可溶化した燕窩食品は、約60%のタンパク質、約10%の中性糖、約10%のシアル酸を含み、ゲルろ過法による分子量は約10万である。この食品の特徴は、燕窩特有のタンパク質とシアル酸を含み、水溶性糖タンパク質としての利用価値は大きい。
燕窩は食材としては最高のシアル酸含有物質であるので、N-アセチルノイラミン酸自身の製造原料となるのは勿論である。著者らは研究の当初から、N-アセチルノイラミン酸の原料として燕窩に注目して中華料理材料店へ出かけて材料を入手した。(第4章参照)これ以外のシアル酸量の多い食品としては、牛乳、鶏卵がある。通常の牛乳はシアル酸量0.2 mg/mLで、初乳は特に含有量が多く0.3〜1.5mg/mLである。卵黄では乾燥重量あたり0.2%であるから、燕窩には如何に大量のシアル酸が含まれているかが分かる。
牛乳ではシアル酸の約75%が2,3-、および、2,6-シアリルラクトース型のオリゴ糖として存在するから、食品としてのシアル酸の形態としては大きく異なるものである。また、鶏卵の卵黄ではN-型糖タンパク質(アスパラギン結合型)の糖鎖の非還元末端に結合して存在する。卵白ではオボムチンと呼ばれるO-型糖タンパク質(セリン結合型)の糖鎖の非還元末端に結合している。その構造は燕窩のO-型糖タンパク質に類似しているが、その構造は燕窩のように複雑でないことは図-5に示した。
KathanとWeeksの研究によると、9)燕窩ムコイドの組成は表のとおりで相当量のシアル酸と灰分を含むのが特長である。約20%に及ぶ灰化成分は塩酸で容易に溶解するカルシウムが多く、この量はシアル酸量と比例する。この報告はカルシウムの含量に前述の中薬大辞典のデータと大きな差異がみられるが、各種の標品について追試実験を繰り返しても、カルシウム含量は多いようである。燕窩の甘み成分は多分にこの大量に含有する結合性カルシウムによると考えられ、また、このカルシウムは可溶性であるからカルシウムを補給するのには有用な食品となるであろう。
| 組成成分 | % |
| プロテイン | 32.3 |
| ヘキソーズ | 16.9 |
| ヘキソサミンa | 12.5 |
| フコース | 0.7 |
| シアル酸b | 8.6 |
| 灰分c | 20 |
a:3N塩酸で4時間100℃で加水分解
b:0.1N硫酸で1時間80℃で加水分解;Neu5Acとして計算
c:910℃で24時間灰化
Pozsgayらの研究によると、11)燕窩を酸加水分解して後イオン交換クロマトグラフィーを行って分離すると、期待されるN-アセチルノイラミン酸の他に、約半量に及ぶ4,8-アンヒドロ誘導体(16)をえた。やや多すぎるこの副産物は燕窩の構造の中で、末端糖鎖のシアル酸が4,5-ジアセタート構造をもっている可能性を示唆するものである。12)しかし、燕窩のシアロ糖鎖は緩和な条件で4,8-アンヒドロ誘導体(16)を生成することや、人の耳垢の中から発見されて我々が合成した2,7-アンヒドロ誘導体(15)の存在と対比して興味深い。13,14)
燕窩中のシアル酸の構造が主に、N-アセチルノイラミン酸(14)であることは多くの実験で確実になっている。加水分解したとき、シアル酸のほかに4,8-アンヒドロ-N-アセチルノイラミン酸(16)がえられること、第3章に詳述するように表皮成長因子活性があることや、インフルエンザウイルスと結合することなど、燕窩のムコイドが生理活性を示すために必要な立体構造をもつ事実を支持するものと考えられる。11)
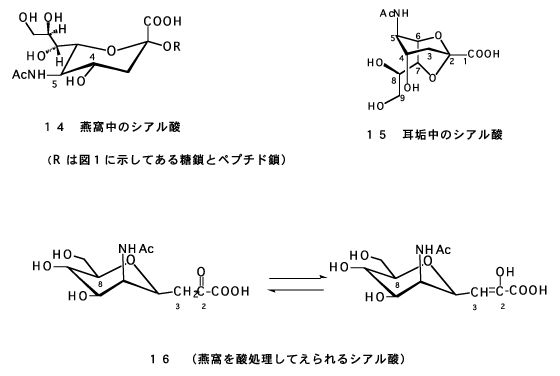
このように燕窩の構成シアル酸は5位(N-)がアセチル化されたN-アセチルノイラミン酸であることは各種の反応から明らかである。7位アセチル誘導体は含まないことは比旋光度の値からも、また、過ヨード酸・チオバルビツール酸試薬との反応(アミノフ試薬)で発色することからも明らかである。(図-6)
| シアル酸の種類 | アミノフ試薬 | 比旋光度 [a]D |
| N-アセチルノイラミン酸 | 発色 | −31° |
| N-グリコリルノイラミン酸 | 発色 | −32°(23℃;H2O) |
| 4-O-アセチル-N-アセチルノイラミン酸 | 発色 | −61° |
| −34°(20℃;H2O)15) | ||
| 7-O-アセチル-N-アセチルノイラミン酸 | 無発色 | +6° |
| 燕窩ムコイド | 発色 | −58±1°(22℃;H2O) |
a:3N塩酸で4時間100℃で加水分解
b:0.1N硫酸で1時間80℃で加水分解;Neu5Acとして計算
c:910℃で24時間灰化
最近の研究によると、16)天然燕窩では、N-アセチルノイラミン酸:12.5%、N-グリコリルノイラミン酸0.41%に対して、養殖燕窩では、N-アセチルノイラミン酸:6.52%、N-グリコリルノイラミン酸0.09%となっていて、天然燕窩のシアル酸量が養殖燕窩に比べて多いことが分かる。また、相当量のN-グリコリルノイラミン酸を含むことも明らかになった。
文献・注
- 1) 中薬大辞典、上海科学技術出版社、小学館(昭和60年).
- 2) 文献1)にはグルコースの存在記載があるが、糖鎖構造の部に詳述したとおり、何らかの混和物とみるのが妥当である。
- 3) 木幡 陽、箱守仙一郎、永井克孝、“糖鎖の多様な世界”、講談社サイエンティフィク、1993年.
- 4) 小倉治夫、庄司みゆき、“不老長寿の素—ツバメの巣パワーで美容も健康も思いのまま”、楊貴妃出版、2004年.
- 5) 米田文郎、小倉治夫、冨士 薫、“生命有機化学”、講談社サイエンティフィク、1993年.
- 6) F-G. Hanisch and G. Uhlenbruck, Structural Studies on O-and N-Glycosidically Linked Carbohydrate Chains on Collocalia Mucin, Hoppe-Seyler's Z. Physiol. Chem., 365, 119-128 (1984).
- 7) J-M. Wieruszeski, J-C. Michalski, J. Montreuil, and G. Strecker; J.Peter-Katalinic and H. Egge; H. van Halbeek, J.H.G.M. Mutsaers, and J.F.G. Vliegenthart, J. Biol. Chem., 262, 6650-6657 (1987).
- 8) G.Strecker J.M.Wieruszeski, O.Cuvillier, J.C.Michalski, J.Montreuil, 1H and 13C-NMR assignments for sialylated oligosaccharide-alditols related to mucins. Study of thirteen cmponents from hen ovomucin and swallow nest mucin , Biochimie, 74, 39-52 (1992).
- 9) R.H.Kathan and D.I. Weeks, Structure Studies of Collocalia Mucoid I. Carbohydrate and Amino Acid Coposition, Arch. Biochem. Biophys., 134, 572-576 (1969).
- 10)未発表
- 11)V.Pozsgay, H.Jennings, D.L. Kasper, Eur. J. Biochem., 162, 445-450 (1987).
- 12)R. Schauer Ed., “Sialic Acids -Chemistry, Metabolism and Function”, Springer-Verlag, Wien -New York, 1982.
- 13)M.Suzuki, A.Suzuki, T.Yamakawa, E. Matsunaga, J. Biochem. (Tokyo), 97, 509-515 (1985).
- 14)K.Furuhata, K. Takeda, H. Ogura, Chem. Pharm. Bull., 39, 817-819 (1991).
- 15)H. Ogura, K. Furuhata, S. Sato, K. Anazawa, M. Itoh, Y. Shitori, Carbohydr. Res., 167, 77-86 (1987) .
- 16)鈴木康夫、第22回シアル酸研究会講演会、Nov. 6 (2004).
